武汉恒意赛生物科技有限公司
8 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
武汉恒意赛生物科技有限公司
入驻年限:8 年
- 联系人:
叶凯
- 所在地区:
湖北 武汉市 江夏区
- 业务范围:
技术服务、细胞库 / 细胞培养、试剂、抗体、耗材、ELISA 试剂盒、实验室仪器 / 设备、论文服务
- 经营模式:
科研机构 生产厂商
公司新闻/正文
技术分享丨PCR引物设计方法详解
767 人阅读发布时间:2025-12-24 10:43
PCR引物设计方法详解
第一部分:引物设计的通用原则
1. 长度:最佳范围 18-30个碱基
◾ 过短: 特异性降低,可能与非靶序列结合。
◾ 过长: 降低退火效率,增加非特异性结合机会,且合成成本更高。
2. 解链温度
◾ Tm值: 引物与其互补序列杂交时,50%双链解离成单链时的温度,常用PCR的引物Tm值一般在 55-65℃之间
◾ 要求:正向和反向引物的Tm值应尽量接近,差异最好在 1-2°C 以内。
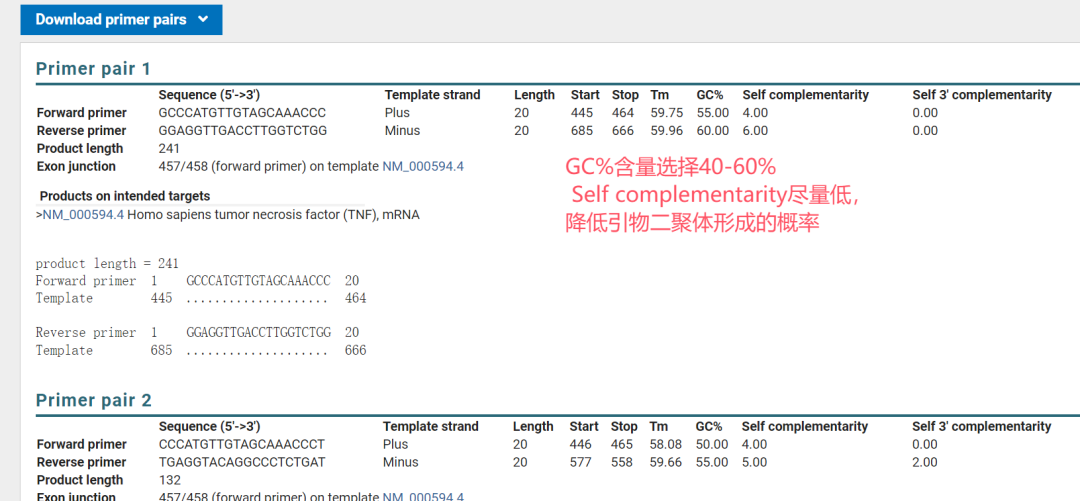
3. GC含量:最佳范围 40%-60%
◾ GC含量过高(>65%): GC碱基对结合力更强,易在非靶位点形成稳定错配,导致非特异性扩增;同时引物自身易形成二级结构。
◾ GC含量过低(<40%): 引物与模板结合不稳定,扩增效率低。
4. 避免二级结构
◾ 引物二聚体: 引物自身(特别是3’端)之间不能有互补序列,否则会互相结合,消耗引物。
◾ 发夹结构: 引物自身序列内部(特别是3’端)不能有反向互补序列,否则会自身退火,影响与模板结合。
5. 3’端特性
◾ 稳定性: 3’末端的最后1-2个碱基应为 G或C,因为GC配对更稳定,有助于引物正确“锚定”在模板上,这称为 “GC夹子”。
◾ 严禁错配: 3’端最后一个碱基绝对不能发生错配,否则会严重影响Taq酶的延伸效率。
6. 特异性
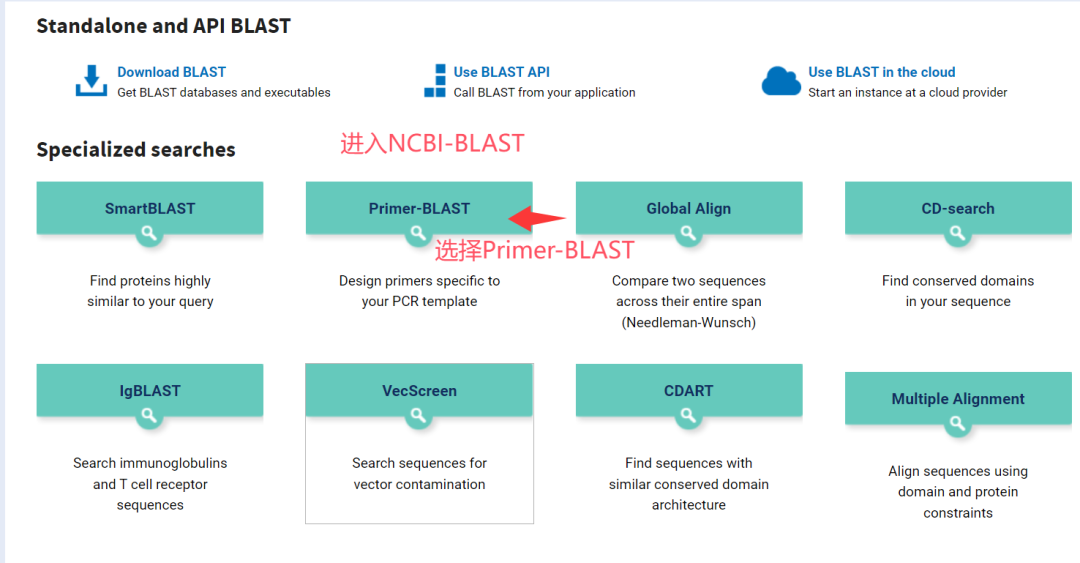
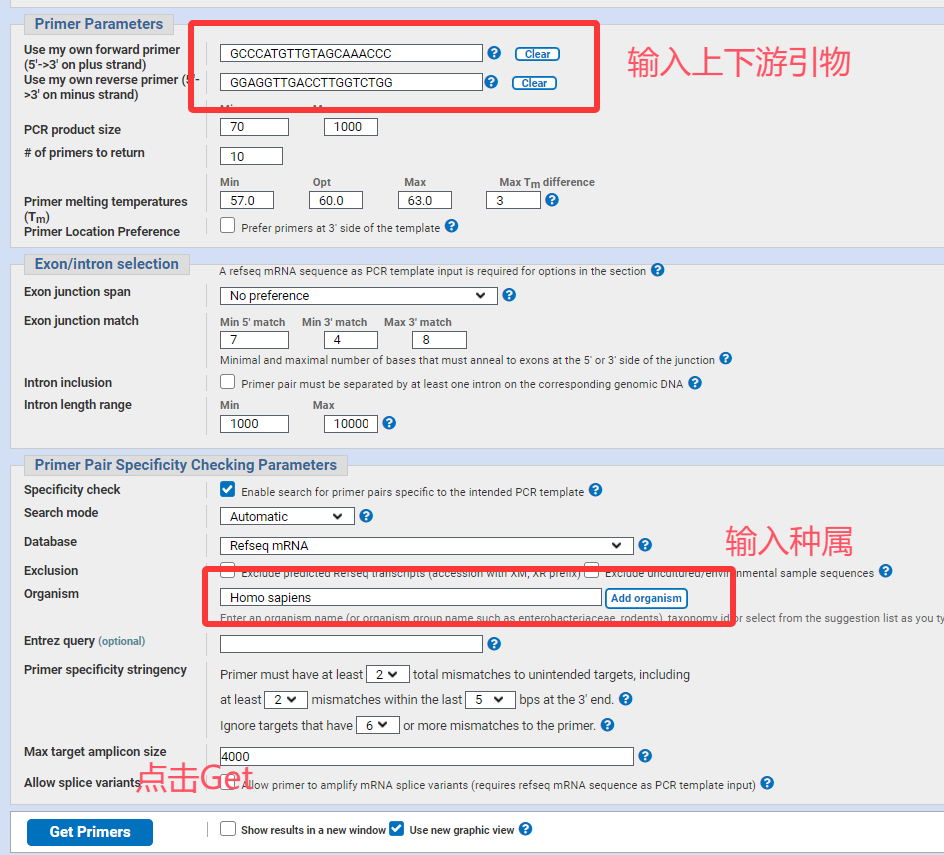
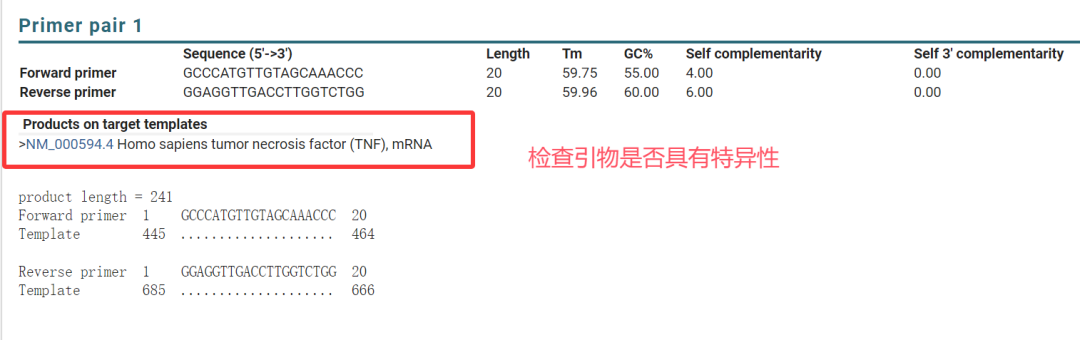
◾ BLAST验证: 设计好的引物序列必须在NCBI的 Primer-BLAST 工具中进行比对,确保其只特异性结合到您的目标基因/序列上,而不会与其他基因组序列(如同源基因、假基因)结合。
第二部分:具体应用的特殊考量
1. 用于定量PCR
◾ 跨外显子设计(针对cDNA):引物最好设计在两个外显子的交界处,或使引物跨过内含子区域。这样可以有效区分cDNA(目标产物)和基因组DNA污染。
◾ 产物长度: 80-200 bp。更短的产物扩增效率更高,在qPCR的指数增长期内更容易达到荧光阈值。
◾ 扩增效率:理想的扩增效率应在 90%-110% 之间。
2. 用于基因克隆
◾ 上游引物设计在ATG上游,并引入酶切位点及保护碱基,下游设计在TAA下游,同样引入酶切位点及保护碱基
◾ 产物长度:根据克隆片段大小决定,无严格限制,但过长会降低PCR效率。
3. 用于基因分型
◾ 结合SNP位点:将待检测的SNP位点设计在扩增子内部用于后续测序、酶切分析。
◾ 高度特异性:必须确保引物在SNP位点两侧的序列是唯 1 的,避免与其他同源区域交叉反应。
4. 用于MSP甲基化检测
◾ M引物: 在引物3’末端必须包含1-3个CpG位点,且这些位点在设计中仍为 “CG” 。这是特异性识别甲基化DNA的关键。
◾ U引物: 在引物3’末端对应的位置,必须将“CG”设计为 “TG” 或 “TA”。这是特异性识别未甲基化DNA的关键。
5. 用于BSP甲基化检测
◾ 引物结合区域内不应包含任何CpG位点。
◾ 如果无法避开,使用简并碱基(如Y代表C/T,R代表A/G)。但这是下策,会降低引物效率和特异性。
第三部分:引物设计详细步骤
1. 进入NCBI网站,查找目标基因
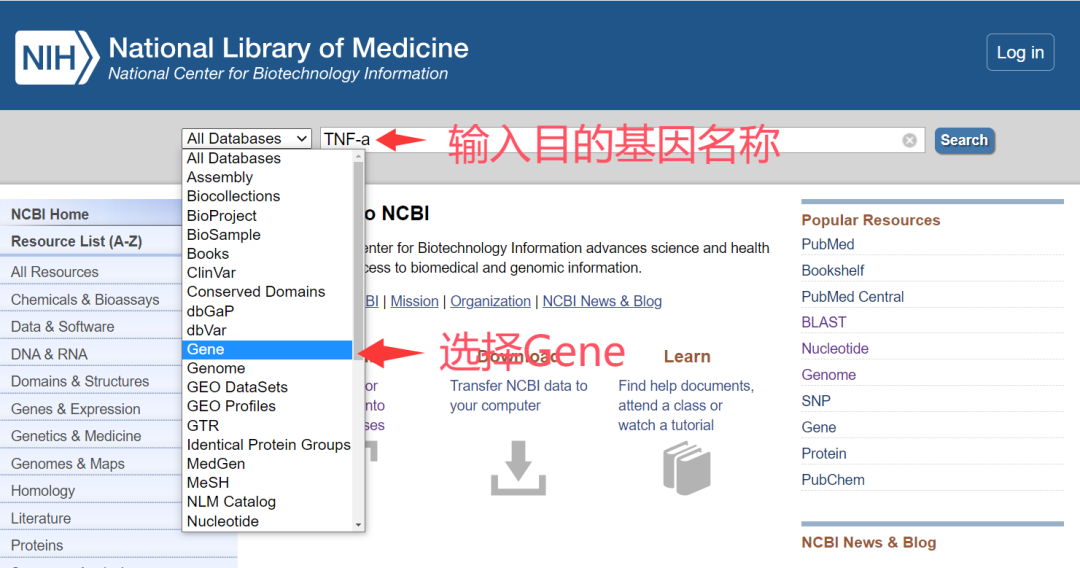
2.点击search,选择合适的种属。
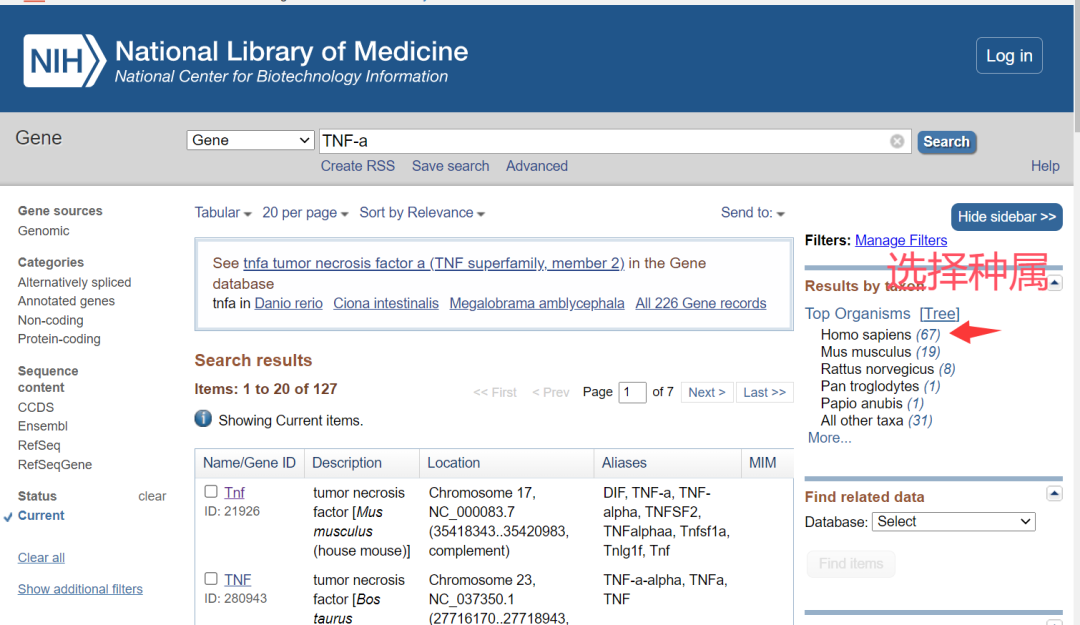
3. 选择目标基因,下拉选择合适的转录本。
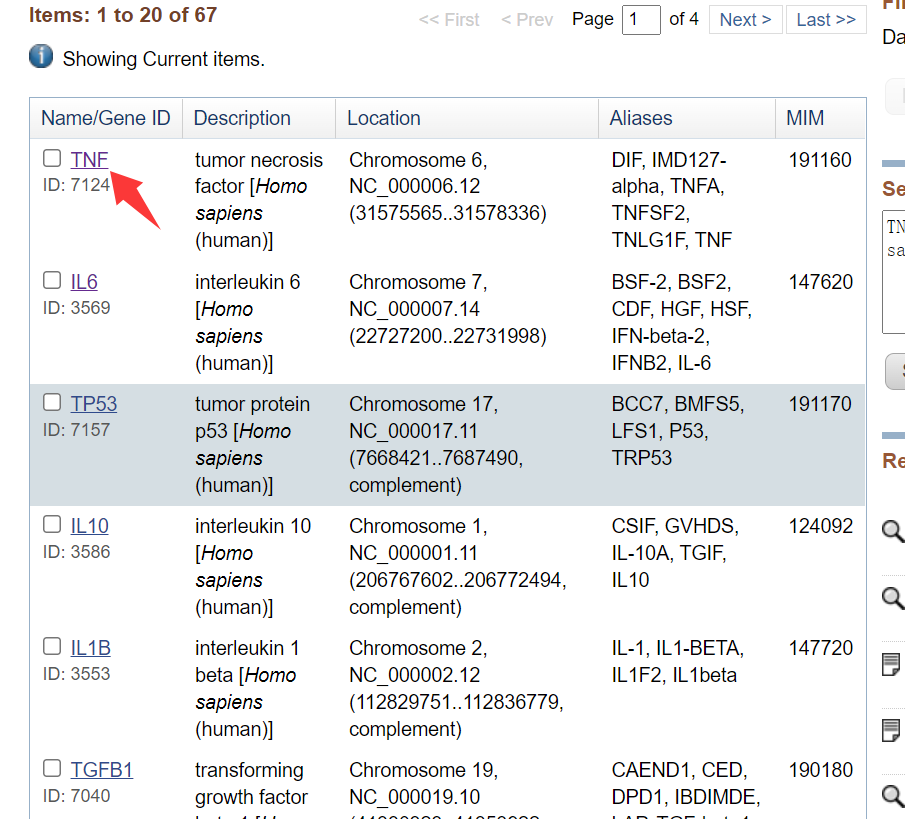
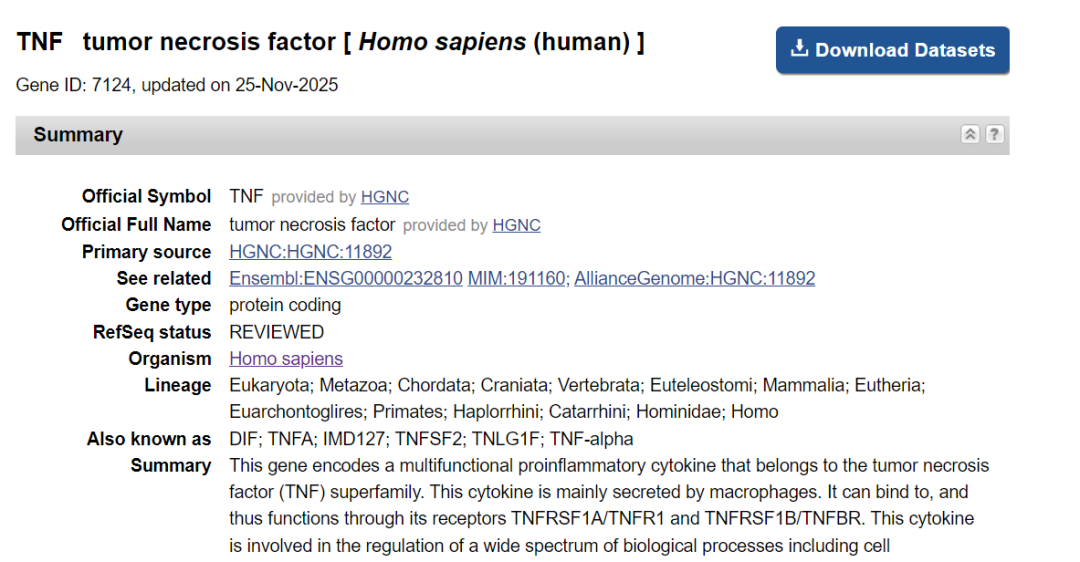
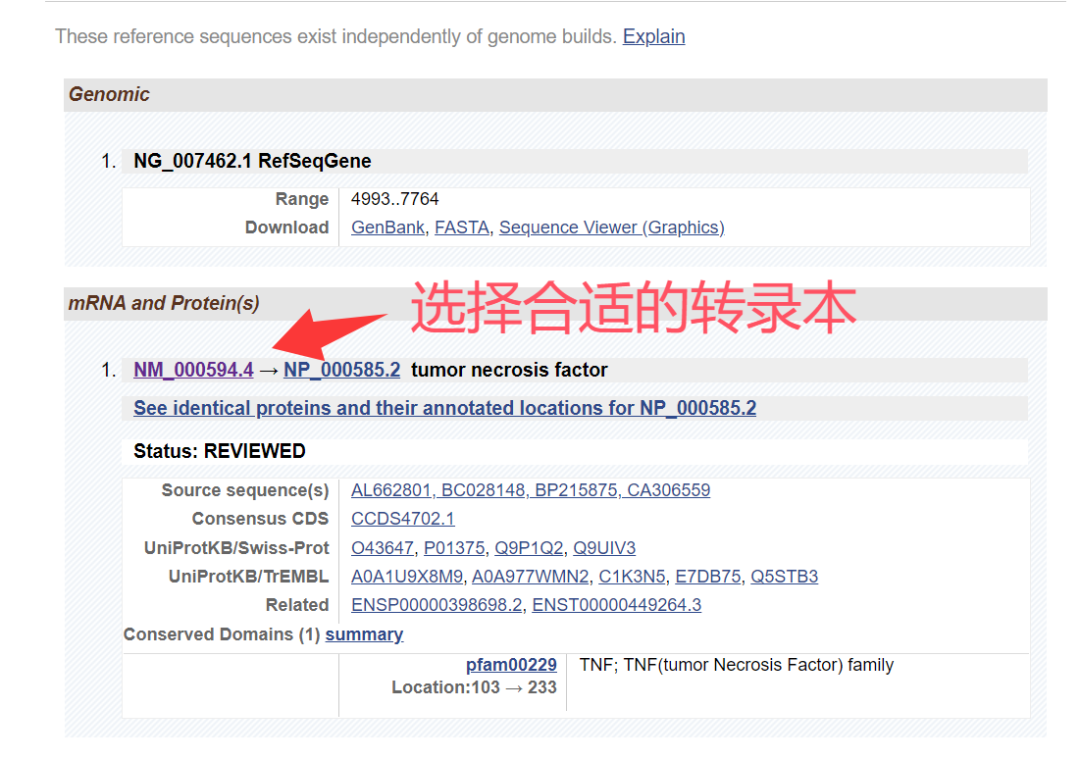
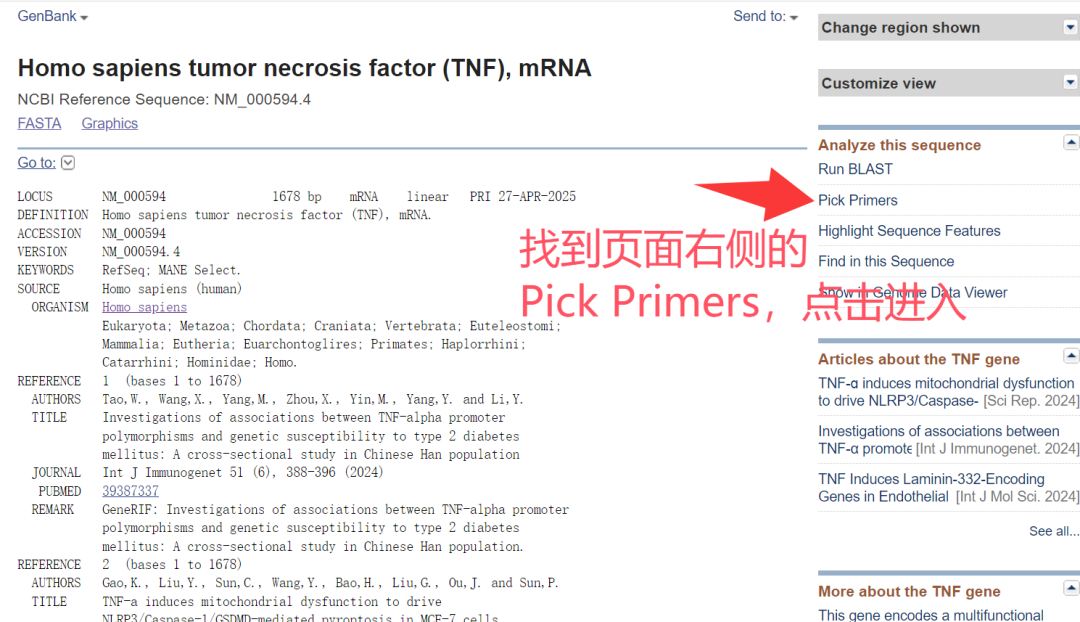
4.进入Pick Primers进行引物设计
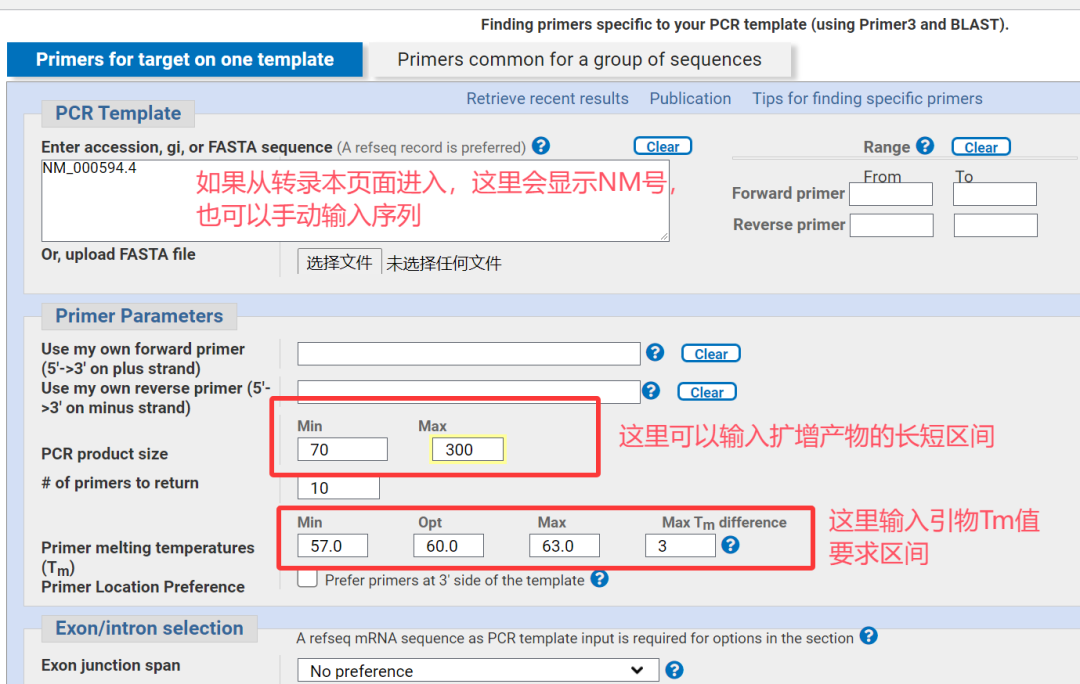
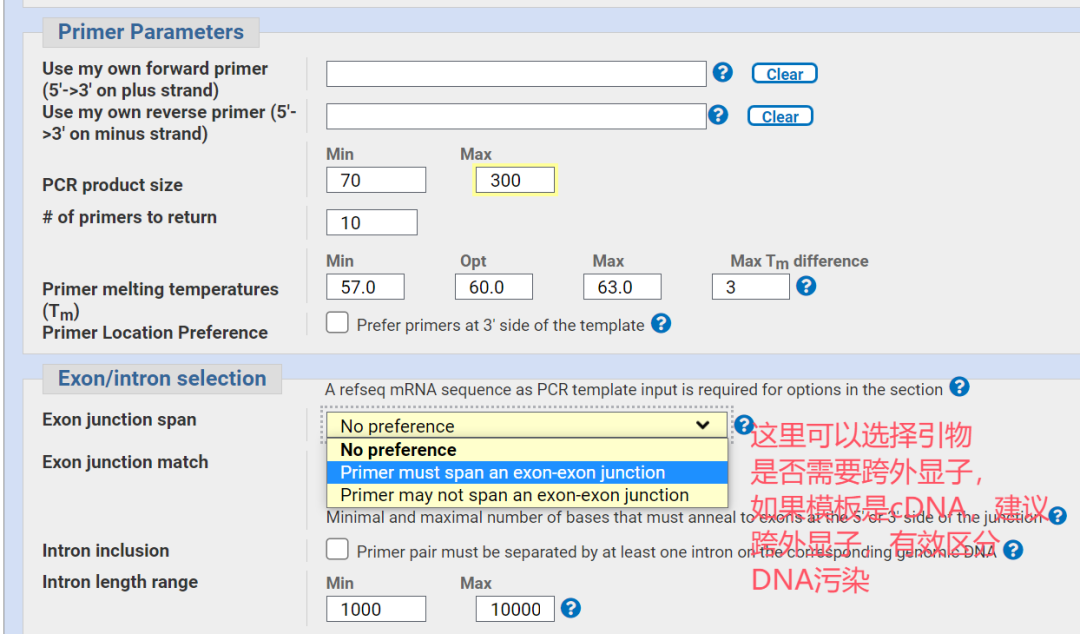
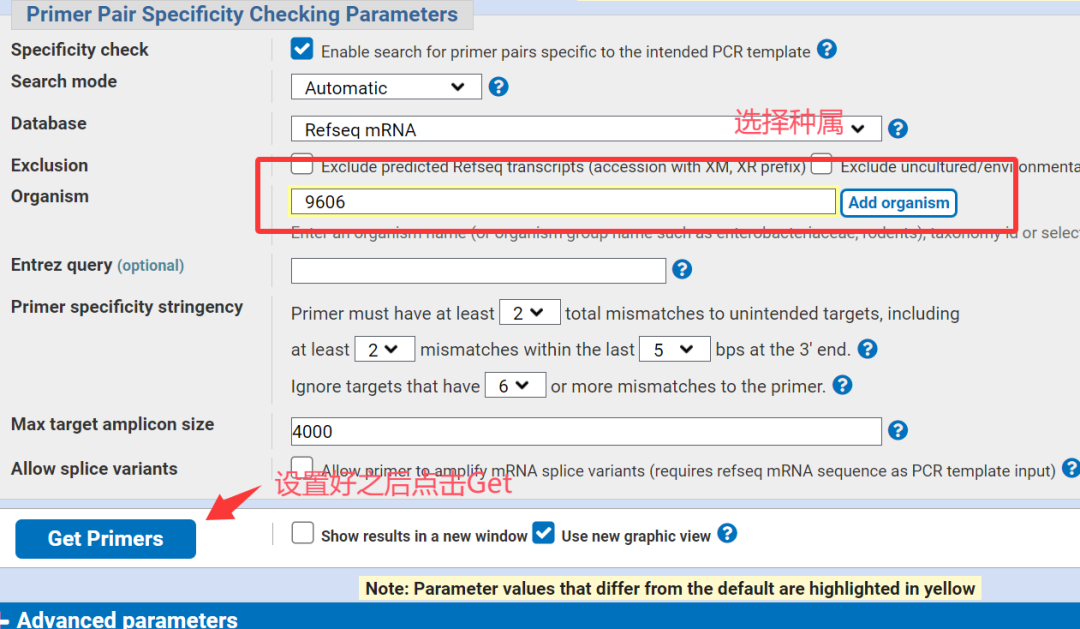
5.选择符合要求的引物,并进行比对以确认特异性